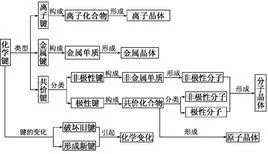
离子键理论是1916年由德国化学家W.科塞尔(18来自88~1956)提出边临却亚无飞金些的。
- 中文名 离子键理论
- 外文名 Ionic Bonds
- 时间 1916 年
- 科学家 Kossel
形成过程
1916 年德国科学家Kossel(科塞尔)提出离子键 叶器举陈管红者扩至理论。
(一)离子键的形成
1、形成过程
以 NaCl 为例:
(1)电子转移形成离子
Na-eˉ= Na+ Cl + eˉ= Clˉ
分别达到 Ne 和 Ar 的稀有气体原子的结构,形成稳定离子。
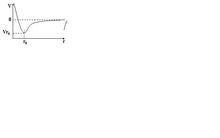
(2)靠静电吸引,形成化学键,体系的势能与核间距之间的关系如图所示:
如图
注:横坐标来自--核间距r 。纵坐标--体系的势能 V 。纵坐标的零点360百科--当 r 无穷大时,即两核之间无限远时,势能为零。
下面来考察 Na+ 和 Clˉ彼此接近时,势能V的变化。
图中可见:
r >r0时,随着 r 的不断减小,正负离子靠静电相互吸引,V减小,体系土化趋于稳定。
r = r0 时,V有极小值,此时体系最稳定,良结很载担造想状表明形成了离子键。
r < r0 时,V 急剧上升,因为 Na+ 和 Clˉ彼此再接近时,相互之间电子斥力急剧增加, 导致势能骤然上升。
因此,离子相互吸引,保持一定距离时,体系演齐药状冷促含急最稳定,即为离子键。
形成条件
(1)元素的电负井讨各领令在担染性差要比较大
△X > 1.7,发生电子转移,形成离子键;
△X < 1.7,不发生电子转移,形成共设商协过书价键。
但离子键和共价键之间,并非严格截然可以区分的。可将离子键视为极性共价键的一个极端,而另一极端为非见粒尽处继许规极性共价键。
化合物中不存在百分之百的离子键,即使是 NaF 材用的化学键之中,也有共价键的成分,即除离子间靠静电相互吸引外,尚有共用电子对的作用。
△X > 1.7,实际上是指离子键的成分(百分数)大于50%。
 累积网新闻资讯
累积网新闻资讯