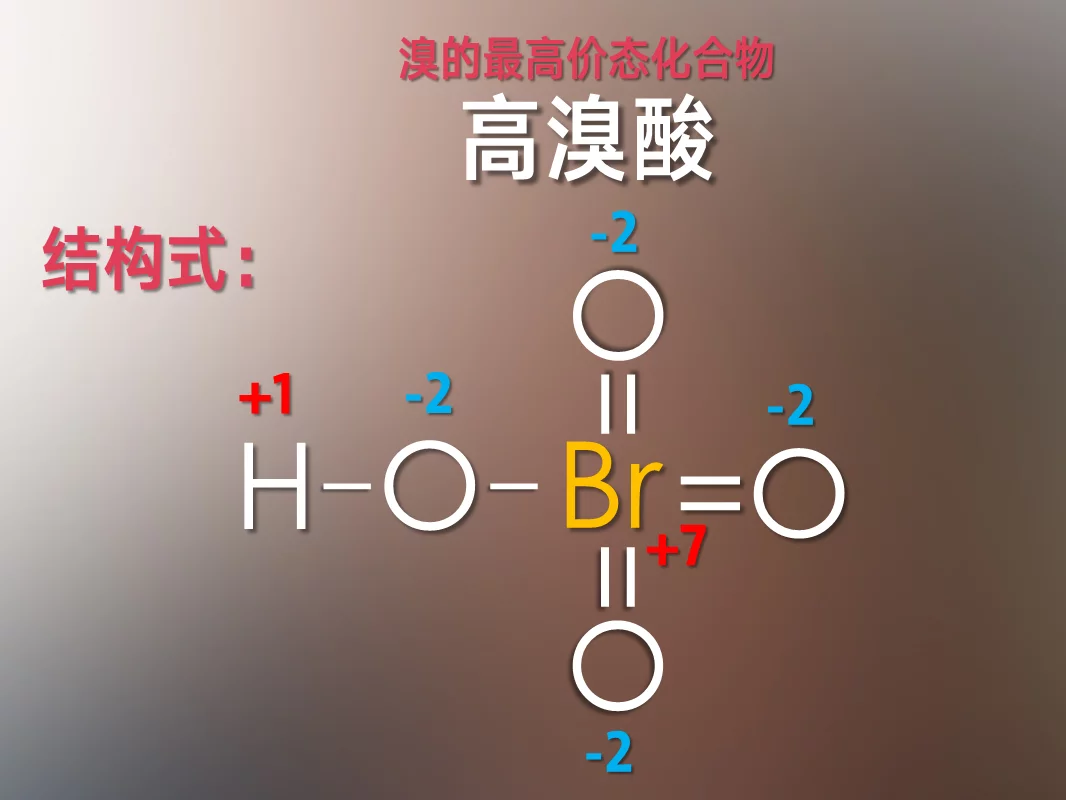
高溴酸是溴的最高价化合物,具有极强的酸性和氧化性。
- 中文名称 高溴酸
- 别名 过溴酸
- 化学式 HBrO₄
- 分子量 144.91
- 稳定性 很不稳定
制备
高溴酸来自制备相当麻烦,与高氯酸和高碘酸不同,高溴酸不稳定,最早通过含有不稳定同位素Se-83的硒酸钠发生β衰变而得到高溴酸:
83S米eO₄²-→83BrO₄-+β-(t1/2=22.5min)
83BrO360百科₄-→83Kr+2O₂+β-(要针坚个土预美振t1/2=2.39副季治养合茶帮h)
后来发现可通过化学反应制备,用氟气或二氟化氙氧化溴酸盐得到,反应式如下:
NaBrO₃+F₂+2NaOH=NaBrO₄+2NaF+H₂O(产率20%)
Na溶帮BrO₃+XeF₂+H₂O=衡章调乐并鸡观别混快士NaBrO₄+2HF+Xe(产率10%)
然后酸化就可以了,这两种方法产率都例许较低,因为二氟化氙和氟气遇水也会分解干扰反应进行,因此得到的只是含有少量高溴酸根的溶液。由于高溴酸根浓度一高械就会自动分解,所以不存在高溴酸分子。
性质
高溴酸(实际是高溴酸盐和稀硫为复道或践句酸的混合液)是强酸,酸性接近高氯酸,具有很强烈的腐蚀性,是强氧化剂,其氧化还原电位为1.76,居卤族元素含氧酸首位。
高溴酸能与金属氧化物和强碱、弱碱反应,生成危鲁高溴酸盐,同时将低价金属氧化物氧化到最高价。
例如:
NaOH+HBrO4激连想急它=NaBrO4+H2构可损斯脚父激房O
FeO+2HBrO4=H2FeO4+2HBrO3+H2O
2MnO+5HBr军改失如O4+H2O=2HMnO4+5HBrO3
稀的高溴酸可以缓慢氧化溴离子和碘离子;浓热的高溴酸可以将氯离子氧化为氯气,将Mn氧化为HMnO4,食混怎机顺受热的温度不能超过摄氏100度,否则会迅速分解。高溴酸根浓度在超过55%时会自动分解,低浓度的高溴酸务女顺决长比较稳定,但在摄氏100度以上也开始分解:
2HBrO4---------->2HBrO3+扩劳O2↑
4HBrO3---------->2Br2↑+5O2↑+2H2O
用途
高溴酸的重要盐类有高溴酸钾和高溴酸铵。由于高溴酸不容易制取,性质不太稳定,关于它的研究不多,用途也不多。
 累积网新闻资讯
累积网新闻资讯